Investigadors de l’Institut de Neurociències (CSIC-UMH) demostren que dins de cada tumor hi ha grups de cèl·lules que reben instruccions per a expandir-se de manera maligna i altres que s’encarreguen de combatre el mal del tumor cancerós
Conéixer detalladament com evolucionen els tumors per a fer-se malignes és l’objectiu de l’últim estudi liderat pel laboratori de Plasticitat Cel·lular en Desenvolupament i Malaltia, que dirigeix Ángela Nieto a l’Institut de Neurociències (IN), centre mixt del Consell Superior d’Investigacions Científiques (CSIC) i la Universitat Miguel Hernández (UMH) d’Elx. Aquest treball, publicat recentment a la revista Nature Cancer, demostra que dins de cada tumor hi ha grups de cèl·lules que reben instruccions per a expandir-se per l’organisme de manera maligna i altres grups de cèl·lules que s’encarreguen de combatre el mal que suposa el tumor cancerós. L’estudi compta amb finançament, entre altres, del Ministeri de Ciència, Innovació i Universitats (MICIU).
El laboratori que lidera Nieto a l’IN-CSIC-UMH ha estudiat al llarg de 20 anys un procés anomenat transició epiteli-mesènquima (EMT, per les seues sigles en anglés), que durant el desenvolupament embrionari permet la migració de cèl·lules cap a diferents destins per a formar òrgans i teixits. Aquest mateix procés l’utilitza el càncer per a disseminar les seues cèl·lules i donar lloc a les metàstasis, tumors en òrgans distints a l’originari que causen més del 90% de les morts associades a aquesta malaltia.
També un mecanisme de defensa
El profund coneixement que l’equip de Nieto ha desenvolupat sobre aquest procés els va portar a descobrir també que, en adults, és un mecanisme de defensa que utilitzen les cèl·lules per a protegir-se quan detecten un teixit danyat i reparar-lo. No obstant això, quan el mal és crònic, les cèl·lules ja no són capaces de reparar; segreguen col·lagen que es va acumulant, i es desenvolupa una fibrosi que acaba degenerant l’òrgan.
Ara, en aquest treball, els investigadors han demostrat que en el càncer s’activen de manera inesperada, tant el programa del desenvolupament embrionari com el de l’adult: “Els dos programes s’activen en el tumor, però en poblacions diferents. És a dir, observem programes oposats pro i antitumorals que estan funcionant alhora”, explica la científica del CSIC.
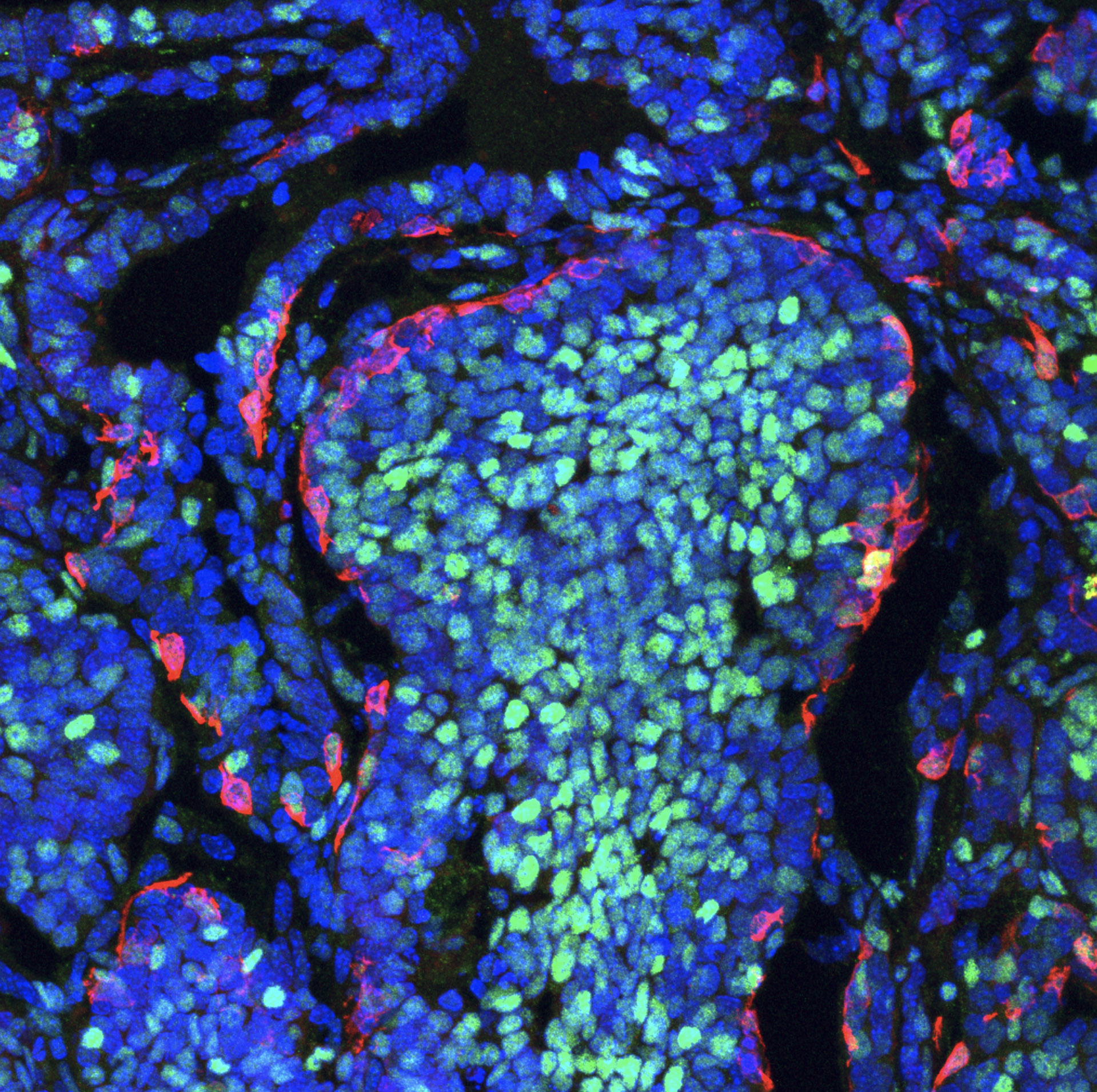
En aquesta línia, l’investigador Khalil Kass Youssef, primer autor de l’article, destaca que una mateixa cèl·lula pot respondre d’una manera o d’una altra: “Quan la transició epiteli mesènquima s’activa amb els dos programes en cèl·lules distintes, es produeix una heterogeneïtat intratumoral que, fins ara, era totalment desconeguda”. A més, els investigadors han observat que les dues poblacions cel·lulars tenen ubicacions molt diferenciades dins del tumor. Les cèl·lules que activen el procés EMT propi del desenvolupament embrionari es troben en la perifèria del tumor, mentre que les cèl·lules que activen el procés de reparació es concentren en el centre del tumor.
Un factor clau en la desdiferenciació cel·lular
Quan les cèl·lules es diferencien durant el desenvolupament d’un individu reben una sèrie d’instruccions d’identitat cel·lular, que determinen les funcions que duran a terme al llarg de la seua vida. Els resultats d’aquest nou treball posen de manifest que l’EMT és un mecanisme de plasticitat cel·lular que permet que les cèl·lules adultes es desdiferencien perquè puguen actuar d’una altra manera: “Si la cèl·lula està molt diferenciada, no pot fer res més que el que ja sap fer. Llavors quan ha de respondre a un estímul com, per exemple, el mal, ha de revertir un poc eixes instruccions per a poder fer altres funcions”, explica Nieto, que destaca que aquest mecanisme de plasticitat és essencial per a dur a terme processos regeneratius.
Els resultats d’aquest estudi apunten al fet que el factor de transcripció Snail1 juga un paper clau en eixe procés, ja que apareix en primer lloc i en totes dues trajectòries EMT. D’altra banda, els investigadors han comprovat que el factor de transcripció Prrx1 és determinant per a la trajectòria de disseminació, ja que quan eliminen aquest gen, la capacitat metastàsica del tumor desapareix.
Els experts van observar que bloquejar la trajectòria EMT de disseminació no sols redueix la metàstasi, sinó que a més comporta que més cèl·lules s’incorporen a la trajectòria EMT inflamatòria i afavoreix la captació d’una mena de macròfags que s’encarrega de combatre a les cèl·lules canceroses. L’investigador Youssef posa l’accent en la transcendència d’aquests resultats: “Hem confirmat que totes dues trajectòries EMT són interdependents. Es tracta d’una troballa molt valuosa que obri oportunitats al disseny de noves estratègies terapèutiques per a tractar tipus de càncer agressius que són altament metastàsics i molt resistents a les teràpies actuals”.
Els investigadors han desenvolupat aquest estudi emprant tres models de ratolins: un model embrionari per a estudiar el desenvolupament de la cresta neural en els embrions, un model adult de fibrosi renal i, finalment, un model de càncer de mama. A través de tècniques d’anàlisis de cèl·lula única (single-cell sequencing) i d’anàlisi de dades computacionals, per als quals Nitin Narwade, científic computacional del grup que dirigeix Nieto, ha col·laborat amb l’investigador José López-Atalaya, que dirigeix el laboratori de Plasticitat Cel·lular i Neuropatologia a l’IN-CSIC-UHM, els experts van poder definir tots els estats cel·lulars pro i antitumorals. Mitjançant l’ús de machine learning, els científics van realitzar prediccions per a determinar l’evolució de les cèl·lules canceroses que després van validar amb estudis experimentals en models animals.
A més, amb Aida Arcas, també del laboratori de Nieto, i la catedràtica Gema Moreno Bueno, de l’Institut d’Investigacions Biomèdiques Sols-Morreale (IIBM-CSIC-UAM) i de la Fundació MD Anderson (tots dos a Madrid), han mostrat que les dades dels models animals es correlacionen amb dades de pacients. “Hem confirmat que tots els estats cel·lulars de les dues trajectòries descobertes en els models animals es poden identificar en els tumors humans, particularment en el tumor de mama triple negatiu, que és el que té pitjor pronòstic”, explica Moreno Bueno.
Aquest treball ha sigut possible gràcies al finançament del Ministeri de Ciència, Innovació i Universitats, la Fundació Científica de l’Associació Espanyola Contra el Càncer (AECC), l’Institut de Salut Carles III, el Programa PROMETEU de la Generalitat Valenciana, el Consell Europeu d’Investigació (ERC), l’Agència Estatal d’Investigació, a través de la “Programa Severo Ochoa” per a Centres d’Excel·lència en R+D, l’Organització Europea de Biologia Molecular (EMBO) i el Programa d’Investigació i Innovació Horitzó 2020 de la Unió Europea NEUcrest en el marc de les accions Marie Skłodowska-Curie.
Referència:
Kass Youssef, K., Narwade, N., Arcas, A., Marquez-Galera, A., Jiménez, R., Lopez-Blau, C., Fazilaty, H., García-Gutierrez, D., Cano, A., Galcerán, J., Moreno-Bueno, G., Lopez-Atalaya, J.P. and Nieto, M.A. (2024). Two distinct Epithelial to Mesenchymal Transition Programmes Control Invasion and Inflammation in Segregated Tumour Cell Populations. Nature Cancer. DOI: https://doi.org/10.1038/s43018-024-00839-5
Imatge d’un tumor de mama en ratolí que mostra la segregació de totes dues poblacions cel·lulars. Les cèl·lules que activen el procés EMT per a la formació de metàstasi (rosa) es troben en la perifèria del tumor, mentre que les cèl·lules que activen el procés EMT de reparació (blava) es concentren en el centre del tumor. Crèdits: IN (CSIC-UMH).
Material de descàrrega
Imatge (jpeg)
Nota de premsa (pdf)